Convalida
La sterilizzazione H2O2 è un processo atossico a bassa pressione e a basse temperature, di norma comprese tra 6 °C e 60 °C, che utilizza il perossido di idrogeno vaporizzato per ridurre i livelli degli agenti infettivi. La soluzione Aquarius H2O2 viene introdotta nel vaporizzatore, riscaldata mediante radiofrequenza (RF) e convogliata nella camera principale in condizioni di vuoto, generando il plasma. Si predilige questo processo per i prodotti che non sono in grado di tollerare il calore tipico della sterilizzazione in autoclave (ad esempio, la plastica) o che presentano spazi di diffusione limitati, quali i dispositivi medici con lume ridotto. I parametri principali da monitorare sono la pressione e il vuoto (di norma, tra 1000 mbar e 0,3 mbar), l’energia di radiofrequenza convogliata, la concentrazione di H2O2 e la temperatura (50-60 °C). Un elemento interessante, ma non indispensabile, è l’umidità relativa (85-90%).
La durata totale del processo può variare a seconda dei prodotti, ma di norma i cicli richiedono da una a due ore. Si tratta di un altro motivo per cui questo metodo di sterilizzazione a bassa temperatura viene preferito alla sterilizzazione EtO.
Sterilizzazione con perossido di idrogeno
La sterilizzazione con perossido di idrogeno è completamente sicura ed ecologica. Durante e dopo il processo di sterilizzazione, vengono generati solo ossigeno e vapore acqueo, dunque non sono presenti residui tossici. I prodotti deperibili non sono esplosivi, infiammabili o tossici.
Gli sterilizzatori a perossido di idrogeno presentano solo alcuni svantaggi. Poiché il perossido di idrogeno è un forte ossidante, vi sono alcuni problemi di compatibilità dei materiali, ad esempio nel caso dei prodotti cartacei, i quali non possono essere sterilizzati a causa della cellulosa, che assorbirebbe completamente il perossido di idrogeno.
Processo
La sterilizzazione al plasma di perossido di idrogeno si avvale di basse temperature, umidità ridotta e gas plasma. Il gas plasma corrisponde al quarto stato della materia e consiste in nuvole di ioni, neutroni ed elettroni prodotte dall’applicazione di un campo elettrico o magnetico.
La procedura di sterilizzazione è suddivisa in cinque fasi:
- Una fase di vuoto, in cui la camera viene evacuata a circa 0,1-0,3 mbar
- Una fase di iniezione, in cui viene iniettato il perossido di idrogeno liquido, che provoca l’evaporazione e la dispersione nella camera della soluzione Aquarium H2O2
- Una fase di diffusione, in cui il vapore di perossido di idrogeno permea la camera, uccidendo qualsiasi batterio superficiale; inoltre, la pressione della camera si riduce e ha inizio la fuoriuscita di plasma
- La fase del plasma, in cui viene generato un campo elettromagnetico, separando il vapore e producendo una nuvola di plasma di radicali liberi a bassa temperatura, ad esempio l’idroperossile e l’idrossile, che reagiscono notoriamente con la maggior parte delle molecole essenziali per il normale metabolismo delle cellule viventi
- Una fase di sfiato, in cui la camera viene sfiatata per uniformare la pressione e consentire l’apertura della porta (non è necessario procedere all’aerazione o al raffreddamento, dunque la camera può essere riutilizzata immediatamente)
Procedura di sterilizzazione H2O2
La procedura di sterilizzazione ha inizio collocando l’oggetto da sterilizzare nella camera a vuoto, dove viene iniettato e vaporizzato il perossido di idrogeno a una concentrazione minima di 6 mg/l. Il gas di perossido di idrogeno si diffonde quindi in tutto il carico dello sterilizzatore per circa 50 minuti. Viene applicata un’energia di radiofrequenza pari a 400 watt per creare il gas plasma di perossido di idrogeno. In seguito, il plasma di perossido di idrogeno si scompone in radicali reattivi che collidono con i microrganismi, uccidendoli. Al termine della fase del plasma, i radicali reattivi perdono la propria energia elevata e si ricombinano per formare ossigeno, acqua e altri sottoprodotti atossici. Il plasma viene mantenuto per un periodo sufficiente a garantire la sterilizzazione completa. Una fase del plasma standard dura circa 15 minuti, mentre la procedura di sterilizzazione richiede in totale circa un’ora. La sterilizzazione al plasma H2O2 a bassa temperatura risulta vantaggiosa nel caso di prodotti non in grado di resistere a temperatura o pressione elevata.
Tali prodotti comprendono, tra gli altri: Cateteri, speciali cateteri diagnostici multielettrodo, endoscopi gastrointestinali, microcateteri di endoscopi morbidi in fibra ottica e strumenti medici o chirurgici sensibili ad acqua o calore (inclusi strumenti operatori e ortopedici, endoscopi, laparoscopi, strumenti chirurgici endocrini, ecc.).
Sfide
I cicli di sterilizzazione H2O2 vengono eseguiti in camere attentamente sigillate per mantenere il vuoto. L’utilizzo di termocoppie o, in generale, di sistemi cablati è estremamente complesso, se non impossibile.
I data loggers senza fili TrackSense Pro eliminano la necessità di passanti. La capacità di archiviare 60.000 punti di rilevamento offre uno spazio di memoria sufficiente per l’intero ciclo e le dimensioni ridotte consentono un posizionamento semplice all’interno della camera. L’utilizzo dei data loggers senza fili di Ellab con l’opzione SKY fornisce il campionamento dei dati in tempo reale, senza correre il rischio di compromettere l’integrità della camera.
L’efficacia di un ciclo di sterilizzazione H2O2 dipende dal livello di temperatura e pressione del ciclo, dunque è importante monitorare e convalidare questi parametri durante l’intero processo.
Sterilizzazione H2O2
A differenza della sterilizzazione EtO, la sterilizzazione H2O2 è un processo semi-secco, dunque non sono assolutamente necessarie misurazioni dell’umidità relativa. I sensori robusti e di alta qualità di Ellab offrono la massima accuratezza di misurazione e consentono un ciclo di convalida completo, riducendo significativamente il tempo di configurazione. I loggers TrackSense sono realizzati in acciaio inox e i componenti elettronici sono sigillati ermeticamente, prevenendo la possibile ossidazione o penetrazione di sostanze chimiche.
Acquisto
Acquista l’apparecchiatura di convalida di Ellab ed esegui autonomamente studi di convalida, in qualsiasi momento e luogo.
Rentals
Noleggia l’apparecchiatura di Ellab e prova i prodotti prima di concludere l’acquisto.
Servizio in loco
Usufruisci di servizi di qualifica e convalida in loco. Disponiamo di ingegneri di convalida formati ed estremamente competenti.
Linee guida
La norma ISO 14937:2009 specifica i requisiti generali per la caratterizzazione di un agente sterilizzante e per lo sviluppo, la convalida nonché il monitoraggio e il controllo routinario di un processo di sterilizzazione per dispositivi medici.
Si applica ai processi di sterilizzazione in cui i microrganismi vengono inattivati tramite mezzi fisici e/o chimici e deve essere attuata da sviluppatori di processi, produttori di apparecchiatura di sterilizzazione, produttori di dispositivi medici da sterilizzare e organizzazioni responsabili per la sterilizzazione dei dispositivi medici.
Norma ISO
La norma ISO 14937:2009 contiene informazioni generali sui requisiti per IQ, OQ e PQ; sfortunatamente, però, non fornisce indicazioni specifiche su come eseguire la convalida effettiva del processo di sterilizzazione H2O2 in termini di quantità e posizionamento dei punti di misurazione.
Come regola generale, Ellab consiglia di utilizzare almeno 12 punti di misurazione della temperatura (accuratezza +/-0,5 °C), un punto di misurazione della pressione/del vuoto (accuratezza +/-15-20% delle letture) e un sensore RH opzionale (+/-2%). La variazione massima delle misurazioni della temperatura del carico non deve superare 2 °C, 5 °C per le temperature delle pareti. La variazione picco-picco delle misurazioni della pressione/del vuoto deve essere compresa entro il 20-25%.
Metodo
Nell’ambito della convalida di un processo di sterilizzazione H2O2, occorre eseguire una mappatura della camera e monitorare i vari parametri fisici di un ciclo. In particolare, il monitoraggio della temperatura e della pressione è fondamentale per valutare le prestazioni di un ciclo di sterilizzazione H2O2. Sono necessari test sia a camera vuota sia a camera carica.
Si consiglia di formulare i criteri di accettazione per le prestazioni sulla base dello scenario peggiore.
Il numero di sensori di temperatura viene stabilito in base alle dimensioni della camera, mentre è necessario un solo sensore di pressione/vuoto. La posizione dei sensori deve fornire una rappresentazione utile della disposizione della camera. L’elaborazione di una mappa termica a camera vuota indica la posizione dei punti più critici da monitorare durante il processo (i punti freddi e caldi).
Qualora siano necessari dati in tempo reale, la modularità dell’apparecchiatura TrackSense® Pro offre la funzione opzionale SKY, che consente di visualizzare i dati in tempo reale nel software ValSuite™.
La creazione e la documentazione della posizione dei sensori rappresentano una parte importante della documentazione. Utilizzando lo strumento Unità con le immagini opzionali del software ValSuite™ Pro, è possibile disporre di una mappa documentata relativa al posizionamento dei sensori, che faciliterà l’esecuzione di studi ripetibili e comparabili.
Dopo aver documentato la posizione dei sensori nel serbatoio, occorre osservare il loro posizionamento all’interno del prodotto. Il software ValSuite™ semplifica la documentazione delle diverse posizioni dei sensori consentendo agli utenti di includere immagini descrittive per ogni canale usato.
Dopo aver raccolto tutti i dati, l’utente deve osservare le caratteristiche del processo. Durante l’analisi della temperatura, di norma la variazione nelle misurazioni della temperatura del carico non deve superare 2 °C. La variazione della temperatura delle pareti non deve essere superiore a 5 °C.
ValSuite
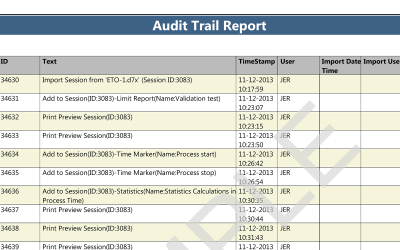
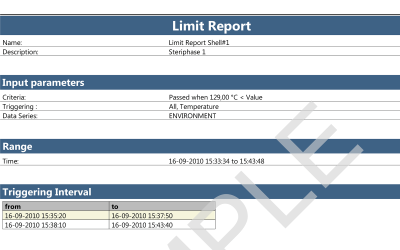
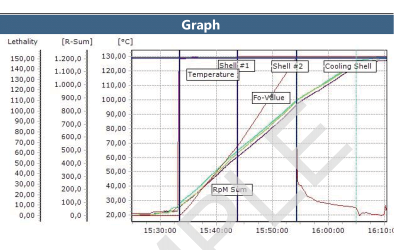
ValSuite fornisce strumenti per analizzare le prestazioni dello sterilizzatore H2O2 in tutte le fasi del processo. L’utilizzo di marcatori temporali contribuisce a generare punti di riferimento analitici e grafici nei dati raccolti. Nel software, inoltre, sono disponibili calcoli statistici, quali i valori minimo, massimo e delta, e la valutazione dei valori calcolati. Il Report dei limiti offre una rapida valutazione delle prestazioni relative al periodo di tempo in cui il processo rispetta i criteri stabiliti.
Il software ValSuite Pro integra tutti i calcoli in report generati automaticamente, senza che sia necessario esportare i dati in un altro software. I report possono includere anche il posizionamento dei loggers all’interno del serbatoio e immagini descrittive del posizionamento dei sensori. Consulta il documento di esempio in PDF. La generazione di report ValSuite™ fornisce la massima sicurezza dei dati per i risultati grazie alla conformità al titolo 21, parte 11, del CFR della FDA.
Un fattore critico per la convalida di qualsiasi sterilizzatore è rappresentato dalla taratura delle sonde al fine di dimostrarne l’accuratezza accettabile. Utilizzando la funzionalità di taratura integrata, gli utenti possono tarare i sensori Ellab a intervalli regolari. Il software ValSuite™ Pro genera un rapporto di taratura semplice da leggere, che include tutte le misurazioni e le tolleranze definite dall’utente. Si consiglia di spedire i sensori e le sonde Ellab almeno una volta all’anno per la taratura di fabbrica (che include un certificato di taratura tracciabile).
Report del software ValSuite®
Sterilizzazione H202